
过渡金属催化的1,3-二烯对映选择性加氢反应为构建手性烯丙胺提供了一种直接的方法。迄今为止,所有报道的实例都使用了亲核胺,并具有3,4-区域选择性。
成果简介
在此,上海交通大学丁奎岭院士,中国科学院上海有机化学研究所王正副研究员和王晓明研究员等人首次使用三甲氧基硅烷和羟胺,并以结构适应性强的芳香族螺酮手性二膦(SKP)为配体,在镍催化下对1,3二烯进行对映选择性1,4-水合反应的实例,从而以优异的区域和对映选择性高产率获得了多种α取代的手性烯丙基胺。这种操作简单的方法具有广泛的底物范围和出色的官能团兼容性,极大地拓展了手性烯丙基胺的化学空间。同时,通过实验和 DFT研究,阐明了该反应的机理,并合理地解释了该反应的区域和对映体选择性。
相关文章以“Nickel Catalyzed Enantioselective 1,4-Hydroamination of 1,3-Dienes”为题发表在J. Am. Chem. Soc.上。
研究背景
手性胺作为亚结构广泛存在于许多药物和生物活性分子中(图1a)。因此,开发用于立体控制C-N键构建的有效策略一直是合成界努力的方向。其中,过渡金属催化的烯烃不对称氢胺反应是各种胺的最直接方法之一。在此背景下,共轭二烯的催化不对称分子间氢胺反应,因其原料的易得性和烯丙胺产品在精细化学合成中的合成多功能性而备受关注。另一方面,在1,3-二烯的催化不对称分子间氢胺反应中控制区域和立体选择性具有挑战性,根据二烯的性质和取代模式,以及试剂和催化剂,可能会产生多达16种相应产物的异构体(图1b)。在过去的二十年里,Hartwig、Malcolmson、Dong、Mazet、和Yin等小组的出色工作报道了一些过渡金属催化的共轭二烯不对称分子间氢化反应,这些反应提供了获得各种光学活性环状或无环状烯丙基胺的有效途径(图1c)。
尽管取得了这些进展,但在所有这些情况下都只得到了加成的氢化产物,而无环二烯的1,4 -区域选择性不对称氢胺化反应仍然难以实现。由于大多数已开发的二烯加氢反应方案都涉及使用亲核胺,从而设想在二烯不对称加氢反应中采用"umpolung "策略(图1d),即通过亲核烯丙基金属中间体与亲电胺化试剂的截取,可能会产生不同于现有方法的区域选择性。据我们所知,迄今为止还没有金属催化1,3-二烯对映选择性1,4-氢化的先例。
图文导读
本文报道了镍催化的1,4-二烯的对映选择性1,3-氢胺化的第一个例子,通过使用SKP作为手性配体,以提供1-芳基取代的(E)-烯丙基胺,其立体中心位于空间位阻更强的碳上,具有出色的对映体过量(图1e)。此外,还通过结合一系列实验和DFT研究来研究其潜在机制,以合理化SKP/Ni催化的共轭二烯的对映选择性氢胺反应的区域选择性和对映选择性。
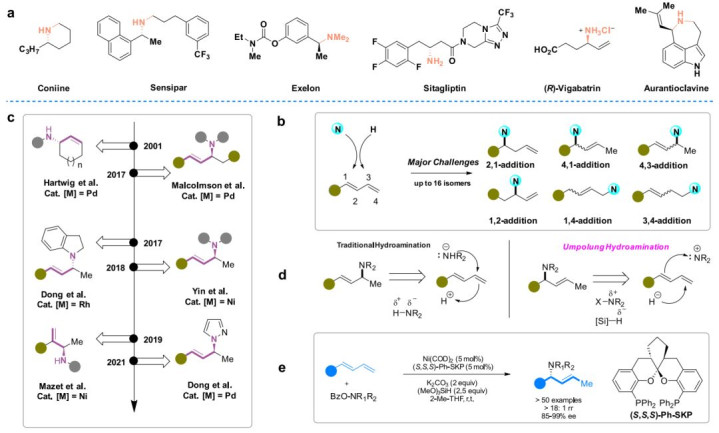
图1:1,3-二烯的催化不对称加氢胺反应。
合成应用
为了证明操作简单的方法在复杂分子结构的后期合成操作中的实用性,将来自某些药物的二烯底物在标准条件下与2a进行不对称氢胺反应,提供含有维生素E(4v)、非布司他中间体(4w)、卡格列净中间体(4x)或恩格列净中间体(4y)的产品,具有优异的区域和对映选择性(图2a)。此外,3e的克级合成进一步突出了这种转化的实用性,该合成使用较低的催化剂负载生产,而不会影响收率或选择性(图2b)。通过利用烯基部分,烯丙胺3e分别容易转化为手性环丙烷3ea或相应的环氧化物3eb,两者均具有良好的收率和高立体选择性(图2c和2d)。此外,作为一种特别有吸引力的丰富原料,1,3-丁二烯1ad在与2q的反应中也表现良好,并顺利地提供了相应的1,4-氢胺产物3qy。此外,2,3-二甲基-1,3-丁二烯1ae也是该反应中合适的偶联伙伴,使相应的产物3qz具有良好的收率(图2e)。
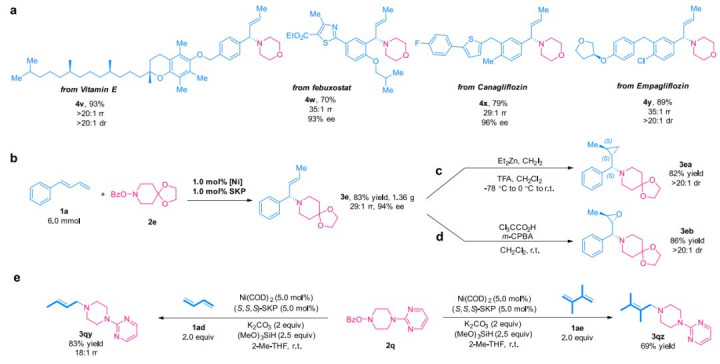
图2:合成应用
机理研究
为了阐明其机理,使用氘代硅烷(Ph2SiD2)作为氢化物源(图3a)。观察到超过99%的氘掺入末端甲基,表明NiH的加入应该是一个不可逆的过程。同时,丁基化羟基甲苯(BHT,一种自由基清除剂)的存在对反应结果没有显著影响,表明自由基中间体不太可能参与转化(图3b)。当具有相反配置的内C=C键(即E-1za与Z-1zb)的二烯与2a反应时,只有E配置的产物6b分别作为高光学纯度的对映异构体获得(图3c)。由同一手性催化剂与这两种二烯立体异构体(E-1za和Z-1zb)形成的相反对映异构体的观察表明,迁移插入应该发生在两个底物的相反面上,并且产生的对映异构体可能是由(SKP)NiH立体选择性迁移插入到二烯的末端C-C双键中引起的。
为了进一步探究影响区域选择性的因素,在标准条件下进行了共轭三烯1ab与2q的反应,以提供1,4-加合物6c作为高区域选择性的主要区域异构体(图3d),这与烷基取代的共轭二烯1u的反应形成鲜明对比,其中相应的区域异构体氢胺产物4u和4u’仅在没有明确偏好的情况下获得。综上所述,这些结果表明1ab中的内烯基与二烯烃1a-t中的芳基取代基一样,可能对反应的区域化学结果产生深远的影响。
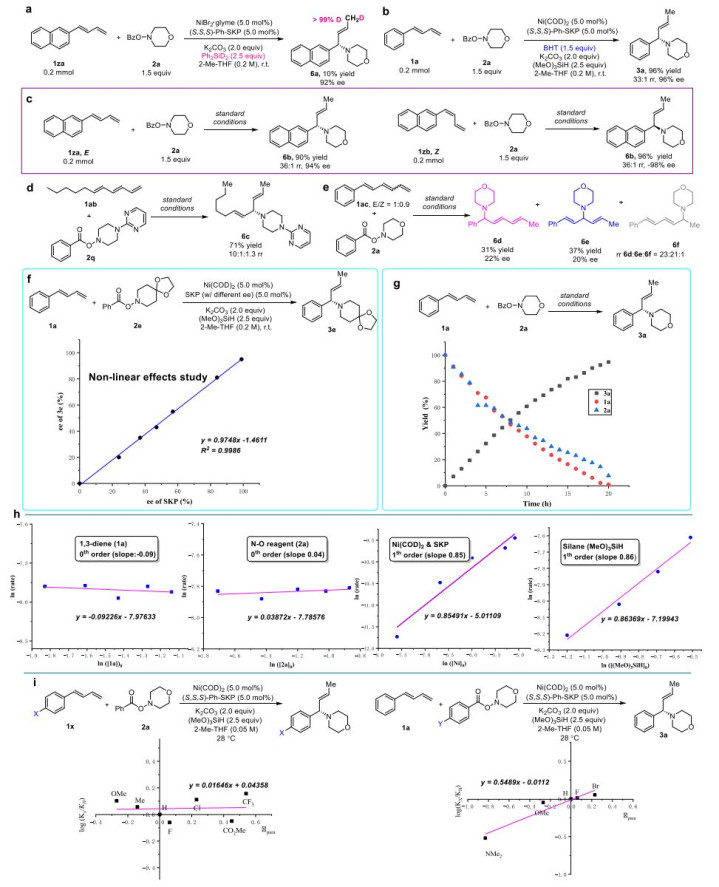
图3:初步机理研究。
密度泛函理论计算
为了进一步理解其机理并合理化区域和对映选择性的起源,作者使用SKP负载的Ni催化剂对二烯1a与苯甲酸吗啉酯2a的氢胺化进行了密度泛函理论(DFT)的计算。图4a描述了为反应机理的区域和对映决定步骤计算的能量分布。发现二烯1a与SKP-NiH催化剂INT1通过TS-1的加氢镍化反应是放能和动力学控制,由于SKP配体的不对称性,二烯1a的氢镍化有四种可能的竞争途径,过渡态用TS1a-d表示,其中(Si)面攻击TS1a的动力学能垒(10.5 kcal/mol)低于所有其他三种途径(11.8-13.9 kcal/mol)。此外,发现两种(Si)-面攻击途径(TS1a/TS1b)都比(Re)-面攻击途径(TS1c/TS 1d)更有利,因此导致INT2a优先形成,并最终形成(S)-3a。随后INT2a与胺亲电试剂2a的反应也可以分别通过四种竞争过渡态(Ts2a-d)进行,导致通过N-O键裂解形成Ni(III) INT3a-d。
根据上述结果和文献,本文提出了一种合理的反应机理(图4c),Ni(I)物质I由SKP结合的Ni前驱体与硅烷在碱存在下生成,将插入1,3-二烯的末端双键,生成相应的π-烯丙基-Ni(I)中间体II。随后,胺亲电试剂在中间体II的Ni(I)中心配位和N-O键裂解将得到高价Ni(III)中间体III,其中SKP以单齿方式与Ni结合。最后,在碱的辅助下,用氢硅烷对IV进行金属转移,将在下一个催化循环中再生NiH(I)。
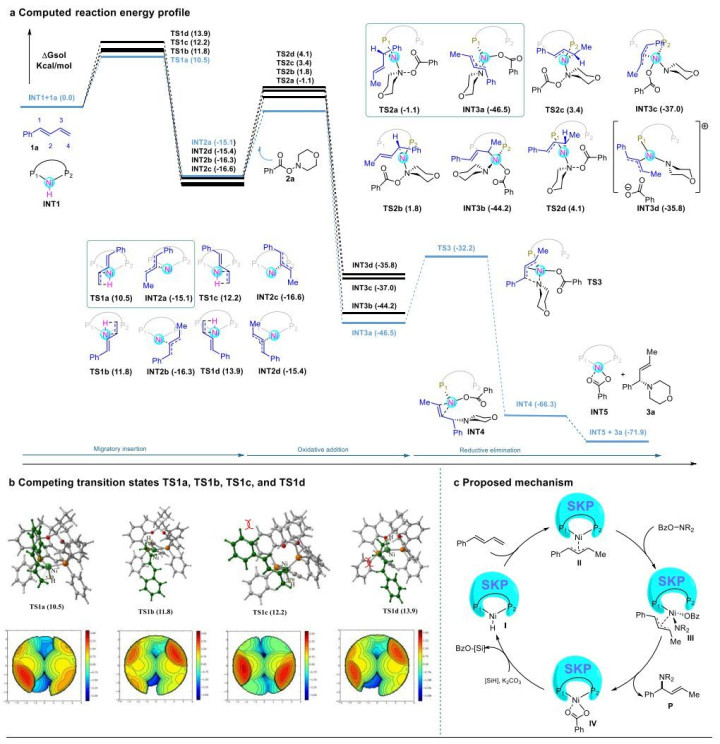
图4:密度泛函理论计算。
结论展望
综上所述,本文开发了一种Ni/SKP催化的1,3-二烯的区域和对映选择性氢胺反应。该方案具有良好的官能团耐受性和温和的反应条件,能够从具有优异的1,,4-区域选择性和高水平的对映体控制(高达99% ee,>20:1 rr)的简单二烯构建一系列对映体富集的烯丙胺(>50个样本)。同时,药物衍生物的成功官能化进一步展示了该反应的制备效用。
在实验和理论研究相结合的基础上,本文提出了一种使观察到的区域和对映选择性合理化的机制。预计这份报告可能会引发更多关于手性二膦配体和地球丰富的过渡金属在不对称催化化学中的应用的研究,其关于SKP/Ni催化的进一步研究正在进行中。
文献信息
Chengdong Wang, Xingheng Wang, Zheng Wang,* Xiaoming Wang,* and Kuiling Ding*, Nickel Catalyzed Enantioselective 1,4-Hydroamination of 1,3-Dienes, J. Am. Chem. Soc., https://doi.org/10.1021/jacs.4c03854